Préparation de solutions d'acide éthanoïque
L'acide éthanoïque (ou acide acétique) de formule semi-développée \(\mathrm{CH_3-CO_2H}\) fait partie de la famille des acides carboxyliques. Pur et à température ambiante, c'est un liquide incolore et à l'odeur piquante caractéristique.
La synthèse mondiale d'acide éthanoïque dépasse les 6,5 millions de tonnes par an. Il possède en effet de nombreuses applications. Dans l'industrie alimentaire, il s'agit du principal soluté du vinaigre ; il est utilisé comme conservateur, correcteur d'acidité et pour l'assaisonnement. Dans les industries chimiques, il est utilisé comme matière première pour la production de nombreux composés et matériaux tels que l'anhydride acétique, l'acétate de cellulose et divers esters.
Objectif : montrer que, lors de la préparation de solutions aqueuses d'acide éthanoïque, ce dernier réagit avec l'eau de façon non totale (l'état final est un état d'équilibre chimique) et que le quotient de réaction à l’état final à une température donnée est indépendant de la composition initiale du système.
Conseils pour les ECE
- La mesure du pH à l'aide d'un pH-mètre et d'une sonde pH est une technique très classique dans les sujets d'ECE. Il faut être capable de la réaliser en autonomie à l'aide de la fiche technique mise à votre disposition.
- Les solutions d'acide éthanoïque ont déjà été préparées soit par dissolution, soit par dilution. On rappelle qu'il faut savoir établir un protocole et le réaliser si jamais cela vous est demandé dans le sujet.
Matériel mis à votre disposition
- Quatre béchers de 150 mL.
- Une solution aqueuse commerciale d'acide éthanoïque notée `"S"_1` à une concentration en soluté apporté `C_\text{acide,1}=1,0\ "mol·L"^-1`.
- Trois solutions aqueuses notées `"S"_2`, `"S"_3` et `"S"_4` préparées par dilution de la solution `"S"_1` à une concentration en soluté apporté respective `C_\text{acide,2}=1,0\times10^{-1}\ "mol·L"^-1`, `C_\text{acide,3}=5,0\times10^{-2}\ "mol·L"^-1` et `C_\text{acide,4}=1,0\times10^{-2}\ "mol·L"^-1`.
- Un thermomètre.
- Une pissette d'eau distillée.
- Un pH-mètre, une sonde pH et une fiche technique.
- Deux solutions tampons.
Lors de la préparation des quatre solutions aqueuses d'acide éthanoïque de concentration en soluté apporté connue, l'acide éthanoïque réagit avec l'eau selon une transformation chimique modélisée par la réaction acide-base d'équation : \(\mathrm{CH_3CO_2H(aq)+H_2O(\ell)\rightleftarrows CH_3CO_2^-(aq)+H_3O^+(aq)}\).
Les couples mis en jeu sont \(\mathrm{CH_3CO_2H/CH_3CO_2^-}\)et \(\mathrm{H_3O^+/H_2O}\).
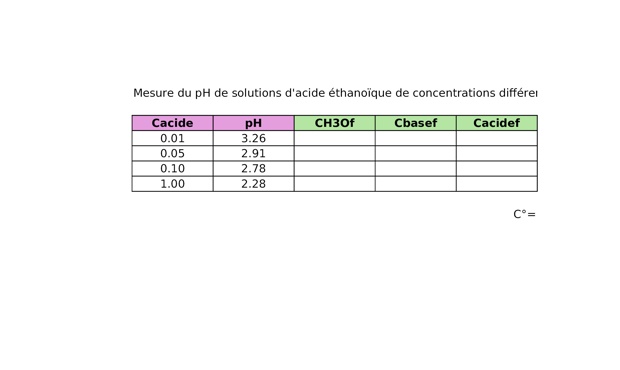
1. Mesurer le `"pH"` des quatre solutions. Rentrer les valeurs obtenues dans un tableur avec les valeurs associées des concentrations en acide éthanoïque apporté (notées Cacide).
Résultats bruts de la question 1 sur un fichier Regressi
Résultats bruts de la question 1 sur un tableur
On rappelle que la concentration en ions oxonium à l'état final du système peut être obtenue grâce à la relation \(\mathrm{C_{H_3O^+,f}=c^o\times10^{-pH}}\).
2. Dans le tableur précédent, calculer pour les quatre solutions la valeur de la concentration en ion oxonium à l'état final (notée CH3Of).
3. D'après l'équation de réaction, en déduire pour les quatre solutions la valeur de la concentration en ion éthanoate (notée Cbasef).
4. D'après l'équation de réaction, calculer pour les quatre solutions la valeur de la concentration en acide éthanoïque à l'état final (notée Cacidef).
5. Montrer que les quatre transformations mises en jeu sont non totales.
On admet que, pour les quatre transformations chimiques étudiées, le quotient de réaction à l'état final a pour expression : \(Q_\text{r,f}=\frac{\mathrm{C_{H_3O^+,f}}\times \mathrm{C_{CH_3CO_2^-,f}}}{\mathrm{C_{CH_3CO_2H,f}}\times{\text{c°}}}\) avec :
- \(\mathrm{C_{H_3O^+,f}}\) : la concentration en quantité de matière à l'état final en ion oxonium en \(\mathrm{mol\cdot L^{-1}}\) ;
- \(\mathrm{C_{CH_3CO_2^-,f}}\) : la concentration en quantité de matière à l'état final en éthanoate en \(\mathrm{mol\cdot L^{-1}}\) ;
- \(\mathrm{C_{CH_3CO_2H,f}}\) : la concentration en quantité de matière à l'état final en acide éthanoïque en \(\mathrm{mol\cdot L^{-1}}\) ;
- \(\text{c}^\text{o}\) la concentration standard, égale à \({\text{c}^\text{o}}=1\text{ mol}\cdot\text{L}^{-1}\).
6. Dans le tableur précédent, calculer pour les quatre transformations chimiques étudiées la valeur du quotient de réaction à l'état final (noté Qrf).
7. Commenter ces valeurs au regard de la composition initiale du système.
Source : https://lesmanuelslibres.region-academique-idf.frTélécharger le manuel : https://forge.apps.education.fr/drane-ile-de-france/les-manuels-libres/chimie-tle-specialite-g ou directement le fichier ZIPSous réserve des droits de propriété intellectuelle de tiers, les contenus de ce site sont proposés dans le cadre du droit Français sous licence CC BY-NC-SA 4.0